
Suatu larutan penyangga dibuat dengan mencampurkan...
Suatu larutan yang mengandung 0,1 mol asam asetat (Ka = 10-5) dan 0,01 mol natrium asetat mempunyai pH sebesar.. A. 3. B. 4. C. 5. D. 6. E. 7. Jawab. 6. Larutan peyangga umumnya mempunyai ketentuan dan sifat-sifat seperti di bawah ini, kecuali. Ke dalam 1 liter larutan asam asetat 0,1 M yang pH nya = 3, ditambahkan garam natrium asetat.

Larutan Penyangga Suatu larutan buffer dibuat dengan cara mencampurkan 0,6 mol asam asetat dan
Larutan Penyangga; pH Larutan Penyangga; Suatu larutan yang mengandung 0,1 mol asam asetat (Ka=10^-5) dan 0,01 mol natrium asetat mempunyai pH sebesar.. pH Larutan Penyangga;. Perhatikan data percobaan berikut.Dari data tersebut yang. Tonton video. Untuk membuat larutan penyangga dengan pH=9 , maka ke da.

Menentukan Ph Larutan Asam Basa Dan Garam Mobile Legends 164808 Hot Sex Picture
Karena, jika kita mengetahui molaritas dari suatu larutan, maka dapat menentukan jumlah mol yang diinginkan. Untuk mengetahui jumlah mol yang diinginkan, maka harus mengukur volume secara tepat. 2. Molalitas (m) Molalitas adalah suatu konsentrasi larutan yang menyatakan banyaknya mol senyawa atau zat setiap kilogram pelarut (Solvent).

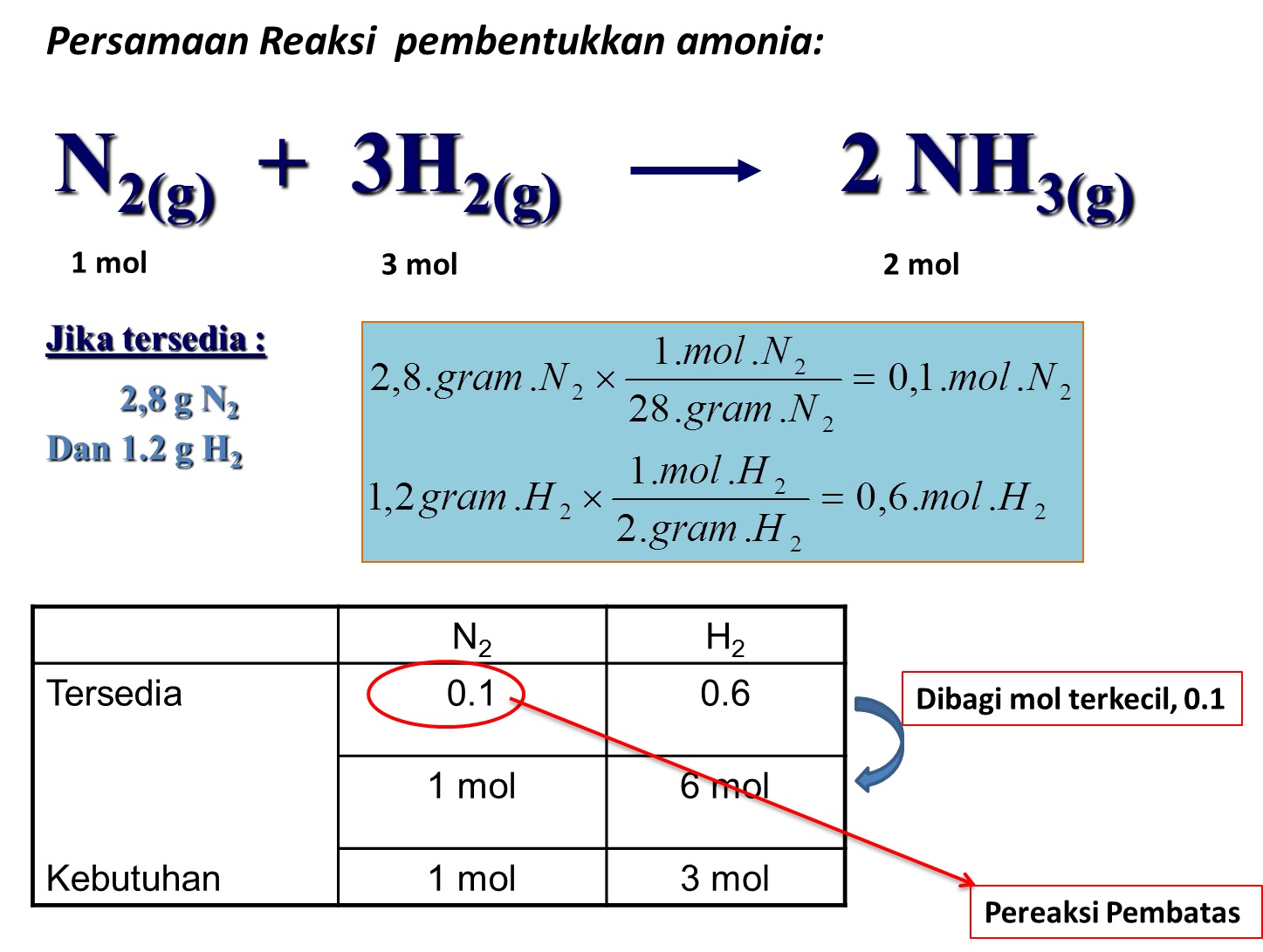
Sebanyak 30 mL suatu larutan amonia tepat bereaksi deng...
Suatu larutan yang mengandung 0,1 mol asam asetat (Ka = 10-5) dan 0,01 mol natrium asetat mempunyai pH sebesar.. A. 3 B. 4 C. 5 D. 6 E. 7 Larutan penyangga umumnya mempunyai ketentuan dan sifat-sifat seperti di bawah ini, kecuali..

Hitunglah molalitas dan fraksi mol larutan NaOH dalam air yang kadarnya 40 (Mr NaOH = 40
Contoh Soal Derajat Keasaman Larutan dan Jawaban. Berikut ini adalah contoh soal tentang materi derajat keasaman dalam larutan: 1. Hitunglah pH larutan asam sulfat 0.05 M. Jawab: Asam sulfat (H2SO4) adalah asam kuat bervalensi 2. [H+] = Ma x a. = 0.05 x 2. = 0.1 mol/L.
Suatu larutan mengandung 0,2 mol CH3COOH dan 0,1 m...
Definisi. Kelarutan (solubility) adalah jumlah maksimum suatu zat yang dapat larut dalam suatu pelarut. Satuan kelarutan umumnya dinyatakan dalam gram/L atau mol/L (M). Hasil kali kelarutan ( Ksp) dinyatakan sebagai hasil kali ion-ion (satuan Molar) dalam larutan jenuhnya, dengan masing-masing konsentrasi dipangkatkan koefisiennya.

Suatu larutan cuka makan mengandung 6 asam asetat. Ji...
log ( [asam] [garam]) = 0. Klik untuk melihat bahasan soal ini. Soal-8. Ke dalam 1 liter larutan asam asetat 0,1 M yang pH-nya 3, ditambahkan garam natrium asetat supaya pH-nya menjadi dua kali semula. Jika Ka asam asetat = 10 -5, maka garam natrium asetat yang harus ditambahkan sebanyak. 1 mol. 0,1 mol.

Titik saat indikator asambasa mengalami perubahan warna
1. Suatu larutan, memiliki fraksi mol zat terlarut sebesar 0,2. Jika ke dalam larutan tersebut ditambahkan lagi zat terlarut yang sama sebanyak 0,2 mol, fraksi mol zat terlarutnya menjadi 1 / 3. Maka banyaknya mol zat pelarut dalam larutan tersebut adalah…. a. 0,4 mol. b. 0,5 mol. c. 0,6 mol. d. 0,8 mol. e. 1,0 mol. Jawaban: Diketahui: X t.

Untuk mengubah 50 mL larutan Ba(OH)2 0,1 M menjadi laruta...
Asam asetat, asam etanoat atau asam cuka adalah salah satu senyawa organik yang berada dalam golongan asam alkanoat. Asam asetat pekat adalah cairan higroskopis tak berwarna, dan memiliki titik beku 16,7°C. Asam asetat adalah komponen utama cuka (3-9%) selain air. Asam asetat berasa asam dan berbau menyengat. Selain diproduksi untuk cuka konsumsi rumah tangga, asam asetat juga diproduksi.

fraksi mol natrium hidroksida(Mr 40)suatu larutan
Suatu larutan yang mengandung 0,1 mol asam asetat (Ka = 10-5) dan 0,01 mol natrium asetat mempunyai pH sebesar.. A. 3 B. 4 C. 5 D. 6. = 0 8. Ke dalam 1 liter larutan asam asetat 0,1 M yang pH nya = 3, ditambahkan garam natrium asetat supaya menjadi dua kali semula. Jika Ka asam asetat = 10-5, maka garam natrium asetat yang harus di tambahkan.
5 Tahapan Reaksi Kimia katelynjou.github.io
Suatun larutan yang mengandung 0,1 mol asam asetat (Ka = 10 -5) dan 0,01 mol natrium asetat mempunya pH sebesar. Suatu larutan yang mengandung 0,1 mol asam asetat (Ka = 10 -5) dan 0,01 mol natrium asetat mempunya pH sebesar . a. 3. b. 4. c. 5. d. 6. e. 7. Jawaban : b. 4 . Pembahasan :

Jika kita akan membuat larutan penyangga dengan pH=6, ke
Dalam video ini kita akan membahas: Suatu larutan yang mengandung 0,1 mol asam asetat \left(Ka=10^{-5}\right) dan 0,01 mol natrium asetat mempunyai pH se.

Suatu larutan yang mengandung 6 gram CH_(3) COOH dan 0...
Tentukan pH setelah reaksi dengan NaOH. pH = - log [H +] = - log (1.77 x 10-4 ) = 3.752. Jadi pH larutan setelah penambahan NaOH adalah 3.752. Suatu larutan terdiri dari asam asetat (CH 3 COOH) dengan konsentrasi 0.05 M dan juga 0.05 M natrium asetat (CH 3 COONa). Hitung perubahan pH jika 0.001 mol HCl ditambahkan dalam satu liter larutan.

Suatu Larutan Bufer Dibuat Dengan Cara Mencampurkan Mol Asam Asetat My XXX Hot Girl
Suatun larutan yang mengandung 0,1 mol asam asetat (Ka = 10 -5) dan 0,01 mol natrium asetat mempunya pH sebesar -----Suatu larutan yang mengandung 0,1 mol asam asetat (Ka = 10 -5) dan 0,01 mol natrium asetat mempunya pH sebesar . a. 3. b. 4. c. 5. d. 6. e. 7. Jawaban : b. 4 . Pembahasan : untuk menghitung asam basa lemah dibutuhkan pengetahuan.

Fraksi Mol Dan Molalitas M Soal Dan Pembahasan Kimia Kelas 12 Riset
Ikut Bimbel online CoLearn mulai 95.000/bulan.IG CoLearn: @colearn.id https://bit.ly/Instagram-CoLearnSekarang, yuk latihan soal ini!Suatu larutan yang menga.

Berapa harga Ka asam asetat jika 0,1 mol CH3COOH dalam 1 liter larutan mengandung 0,001 M ion H+
Pembahasan. Asam lemah adalah asam yang di dalam larutannya hanya sedikit terionisasi sehingga membentuk reaksi kesetimbangan dan memiliki tetapan kesetimbangan asam ( Ka ). Berikut adalah rumus konsentrasi H + pada asam lemah untuk mencari nilai Ka. [H+] 10−3 10−3 10−6 10−110−6 10−5 = = = = = = Ka ×Ma Ka × 1 L0,1 mol Ka ×0,1 Ka.